Les zoonoses fongiques constituent une menace croissante pour la santé humaine, impliquant des conséquences importantes pour la santé publique et la médecine vétérinaire. Parmi ces pathologies émergentes, les aspergilloses sont particulièrement préoccupantes en raison de leur virulence et de leur transmissibilité entre les animaux et les humains.
À quoi ressemble la maladie chez l’animal ?
L’épidémiologie des aspergilloses révèle une prévalence significative chez diverses espèces animales. On constate une attention particulière portée aux oiseaux d’élevage intensif, tels que les dindes, ainsi qu’aux perroquets et perruches en volière. Les mammifères, notamment les chiens, les chevaux et les ruminants, sont également susceptibles d’être infectés par Aspergillus. La distribution géographique des cas d’aspergillose est mondiale, favorisée par un climat chaud et humide suivi d’une période sèche.
La transmission principale de l’agent pathogène se réalise par la voie aérienne, provenant d’environnements contaminés tels que le foin, les grains ou les aliments destinés aux animaux. Les manifestations cliniques de l’infection diffèrent selon les espèces animales concernées. Chez les oiseaux, les symptômes respiratoires sont prédominants, tandis que chez les chiens, on observe fréquemment des épistaxis. Chez les chevaux, les signes incluent principalement des difficultés aiguës à ingérer de la nourriture. Bien que moins fréquente chez les mammifères, l’aspergillose reste une préoccupation, en particulier chez les animaux immunodéprimés. Chez les oiseaux, elle représente une cause majeure de mortalité.
Aspergillose rhino-sinusale du chien
L’aspergillose rhino-sinusale chez le chien affecte les cavités nasales et/ou les sinus, principalement les sinus frontaux. Elle représente 12 à 34 % des cas de maladies rhino-sinusiennes chroniques chez le chien. Elle touche principalement les chiens dolichocéphales, jeunes et actifs. Les tumeurs, les infections bactériennes, les corps étrangers et les traumatismes naso-sinusiens sont des facteurs aggravants. Les symptômes incluent :
- des ronflements,
- de l’épistaxis,
- un jetage mucopurulent,
- une ulcération des narines,
- une truffe parfois hyperkératosique
- et une adénite satellitaire.
Sans traitement, une forme invasive peut se développer. Elle entraîne une lyse osseuse, une déformation faciale, une uvéite, une panophtalmie et une atteinte cérébrale, avec parfois une issue fatale.
Outre cette forme rhino-sinusale, les chiens peuvent également développer une aspergillose pulmonaire, plus rare chez les félins. Des cas d’aspergillose disséminée avec paralysie et douleurs vertébrales ont été rapportés chez le Berger Allemand, bien que n’ayant pas encore été documentés en France.
Le diagnostic de l’aspergillose rhino-sinusale repose sur :
- des signes cliniques et épidémiologiques,
- des analyses sérologiques,
- histologiques,
- cytologiques
- et des cultures mycologiques,
- ainsi que sur l’imagerie médicale.
Le traitement privilégié est la balnéation des cavités nasales et des sinus frontaux avec un dérivé azolé. On peut éventuellement le compléter par un traitement antifongique systémique en cas d’invasion.
Aspergillose de la poche gutturale chez le cheval
L’aspergillose de la poche gutturale chez le cheval, principalement causée par A. nidulans et A. fumigatus, se transmet par contamination oropharyngée lors de l’expiration et de la déglutition. Les symptômes comprennent des ronflements, un jetage mucopurulent, de l’épistaxis unilatérale et intermittente, ainsi qu’une douleur à la palpation parotidienne. Des complications artérielles, veineuses et neurologiques peuvent survenir, provoquant des hémorragies et des troubles tels que la dysphagie et la paralysie laryngée. Bien que rare, les chevaux peuvent également présenter une aspergillose pulmonaire.
Les conditions environnementales favorisant la germination des conidies et les traumatismes tissulaires sont des facteurs de prédisposition. Le diagnostic repose sur des examens histologiques, cytologiques, des cultures mycologiques et des examens d’imagerie médicale tels que l’endoscopie et la radiologie. L’angiographie peut être utile pour localiser les artères lésées.
Le traitement de l’aspergillose de la poche gutturale est principalement chirurgical. La ligature des artères fragilisées par la plaque fongique est essentielle pour stopper et prévenir les hémorragies graves. Cette intervention permet une guérison rapide et spontanée des lésions fongiques en quelques semaines. La ligature de l’artère carotide commune peut être réalisée en urgence pour maîtriser une hémorragie ou sur des animaux de faible valeur économique. En cas d’atteinte du compartiment médial, la ligature de l’artère carotide interne est nécessaire.
Avortement chez le bovins
L’aspergillose chez les bovins entraîne des avortements sporadiques durant le deuxième ou le dernier tiers de la gestation. Cette pathologie n’affecte pas la fertilité de la vache et n’atteint pas systématiquement le fœtus. Les cas d’aspergillose chez les bovins sont principalement observés en hiver, lorsque les animaux sont confinés dans les bâtiments et que l’ensilage est contaminé. La contamination se produit principalement par ingestion. En plus des avortements, des cas d’aspergillose pulmonaire, de mammites aspergillaires et de formes disséminées, notamment chez le veau, ont également été décrits.
Aspergillose chez les oiseaux
L’aspergillose chez les oiseaux, également connue sous le nom d’aspergillose pulmonaire, broncho-pulmonaire ou pneumomycose aspergillaire, est caractérisée par une contamination aérienne, avec l’appareil respiratoire profond comme site de prédilection pour le développement du champignon. Les aspergilloses aviaires sont principalement causées par A. fumigatus, suivie par A. flavus. Les symptômes cliniques sont souvent non spécifiques tels que la léthargie, l’inappétence ou l’anorexie, ou peuvent être directement liés à l’atteinte respiratoire, incluant la dyspnée, la rhinite ou des modifications de la voix. Les poumons et les sacs aériens sont principalement touchés. Le diagnostic repose sur des analyses hématologiques, cytologiques, histologiques, des cultures mycologiques et des examens d’imagerie médicale tels que la radiologie et la tomographie.
Comment se transmet-elle ?
La transmission des Aspergillus se produit principalement par l’inhalation de spores présentes dans l’air. Cela se produit lors de la suspension de poussières contaminées par des moisissures, notamment lors de la manipulation de compost, de foin ou de grains. Contrairement à une croyance répandue, la contamination ne se fait pas à partir d’un animal atteint d’aspergillose, car cette maladie n’est pas contagieuse. Cependant, plusieurs voies de contamination sont possibles, notamment par voie respiratoire, digestive, cutanée, transplacentaire ou transcoquillière. La voie respiratoire reste la plus fréquente, avec les conidies inhalées qui peuvent pénétrer profondément dans l’appareil respiratoire. Les oiseaux, les bovins et les chevaux peuvent être contaminés par inhalation de conidies libérées d’une litière ou d’aliments contaminés.
Les conditions environnementales, telles que la chaleur et l’humidité, favorisent la sporulation des Aspergillus. Cela augmente ainsi la probabilité de contamination de l’air. Les animaux élevés sur des substrats végétaux et nourris à base de fourrage et d’ensilage sont plus susceptibles à la contamination. Cette vulnérabilité se manifeste également chez les individus exposés à des méthodes zootechniques déficientes. De plus, des caractéristiques anatomiques propres à certaines espèces et races, ainsi que la présence de pathologies préexistantes, de traumatismes ou de corps étrangers peuvent accroître le risque de développer une aspergillose.
La maladie se développe plus facilement chez les individus immunodéprimés, stressés ou exposés à des thérapies prolongées telles que l’antibiothérapie ou la corticothérapie. Elle peut affecter diverses espèces domestiques et animaux sauvages en captivité, avec des formes cliniques et des localisations variées en fonction de l’hôte.
Quels sont les symptômes chez l’Homme ?
Chez l’humain, les aspergilloses touchent principalement les individus immunodéprimés, devenant ainsi des infections opportunistes. Les causes de cette immunodépression sont diverses : infection par le VIH, aplasie due à une chimiothérapie ou une leucémie aiguë, traitement immunosuppresseur suite à une greffe d’organe, voire des déficits immunitaires congénitaux. La neutropénie constitue le principal facteur de risque d’infection grave, dite invasive. Les principaux facteurs de risque d’aspergillose sont :
- Neutropénie prolongée (typiquement > 7 jours)
- Corticothérapie à fortes doses et de longue durée
- Transplantation d’organes, en particulier la greffe de moelle osseuse avec maladie du greffon contre l’hôte (GVHD)
- Troubles héréditaires de la fonction neutrophile, comme la granulomatose chronique
A. fumigatus est la cause la plus courante d’infections pulmonaires invasives. L’aspergillose bronchopulmonaire allergique est une réaction d’hypersensibilité à A. fumigatus, déclenchant une inflammation pulmonaire indépendante de l’infection fongique. Les infections focales se localisent généralement dans les poumons, formant parfois des aspergillomes, masses de filaments inclus dans une matrice protéique, observées notamment chez les patients ayant des cavités pulmonaires préexistantes. L’aspergillose invasive pulmonaire est la forme la plus grave, touchant principalement les patients immunodéprimés, et constitue une cause majeure de décès dans les unités de traitement des leucémies et des transplantations d’organes.
Présentation clinique
Il existe deux formes d’aspergilloses : invasive et non invasive. La forme invasive, plus sévère, implique une invasion du parenchyme pulmonaire par le champignon, qui peut ensuite se diffuser dans d’autres organes, entraînant un risque de lésions artérielles, d’ischémie, de nécrose et de destruction du parenchyme pulmonaire.
Une étude de 2000 menée par l’Agence nationale d’accréditation et d’évaluation en santé (ANAES) et la Société française d’hygiène hospitalière (SFHH) identifie deux principaux facteurs de risque d’aspergillose invasive en milieu hospitalier : l’immunodéficience de l’hôte et les facteurs exogènes environnementaux. Parmi ces derniers, les travaux réalisés sur le site d’hospitalisation entraînent une augmentation significative des risques. Les gros travaux de construction ainsi que les petits travaux d’entretien multiplient les concentrations aériennes de spores d’Aspergillus fumigatus, flavus et niger.
Le spectre clinique des aspergilloses est large, variant en gravité et en site atteint. Les signes cliniques dépendent du type d’infection et de sa localisation, mais le poumon est principalement affecté.
L’aspergillose pulmonaire se divise en trois types : invasive, aspergillome et bronchopulmonaire allergique. L’aspergillose pulmonaire invasive, grave, survient principalement chez les patients immunodéprimés neutropéniques et peut entraîner une septicémie. À l’inverse, l’aspergillome est une infection locale dans une cavité pulmonaire colonisée par Aspergillus. Enfin, l’aspergillose bronchopulmonaire allergique résulte d’une réaction allergique à Aspergillus et présente des symptômes similaires à l’asthme.
L’aspergillose peut également toucher la peau, se manifestant sous forme de nodules, de plaques érythémateuses ou de maculopapules, ainsi que les sinus, avec une sinusite aspergillaire. Elle peut aussi affecter le cerveau, provoquant une méningite ou une encéphalite, surtout chez les immunodéprimés ou après une contamination locale.
Formes invasives
L’aspergillose invasive est une maladie infectieuse grave causée par la diffusion généralisée d’un champignon du genre Aspergillus, principalement Aspergillus fumigatus. Elle affecte surtout les patients immunodéprimés, constituant ainsi la deuxième cause de mortalité hospitalière due à une infection fongique. L’atteinte pulmonaire est la plus courante. Elle survient principalement chez les patients immunodéprimés, en particulier en cas de neutropénie. Environ 5 à 25 % des patients atteints de leucémie aiguë, 5 à 10 % des greffés de moelle osseuse et 0,5 à 5 % des patients sous traitement anti-rejet après une greffe d’organe sont touchés. Les différentes greffes d’organes n’exposent pas de la même manière au risque d’aspergillose invasive, avec une prévalence plus élevée chez les greffés cœur-poumon, suivis du foie, du cœur, du poumon et du rein. De plus, les patients atteints du VIH sont également de plus en plus touchés par cette maladie.
Les manifestations cliniques des aspergilloses invasives dépendent de l’organe infecté et de la condition sous-jacente. Quatre types principaux sont distingués : l’aspergillose pulmonaire invasive aiguë ou chronique, la trachéobronchite et la bronchite obstructive, la rhinosinusite aiguë invasive, et enfin l’aspergillose invasive diffuse, impliquant plusieurs organes tels que le cerveau et la peau. Des complications peuvent également survenir dans les reins, le cœur, la moelle osseuse et les yeux, bien que moins fréquentes. La fièvre n’est pas toujours présente, surtout chez les patients sous corticothérapie. L’aspergillose invasive constitue ainsi la deuxième cause de mortalité hospitalière due à une infection fongique.
Formes non invasives
Les aspergilloses non invasives se caractérisent par la prolifération localisée du champignon sans propagation diffuse dans l’organisme. Les formes les plus fréquentes sont l’aspergillome et la sinusite aspergillaire, cette dernière pouvant évoluer vers une forme invasive.
L’aspergillome, ou aspergillose pulmonaire chronique, résulte de la colonisation d’une cavité pulmonaire par un champignon du genre Aspergillus. Il survient souvent comme complication des cavernes tuberculeuses, séquelles courantes de la tuberculose pulmonaire, conduisant à une destruction locale du poumon. Chaque année, environ 370 000 personnes développent un aspergillome, avec différentes formes selon la taille et le degré de destruction pulmonaire associée. Les saignements, provoquant une expectoration de sang représentent une complication majeure des aspergillomes, parfois engageant le pronostic vital.
Concernant la physiopathologie, la formation des cavernes tuberculeuses résulte de la destruction du parenchyme pulmonaire après l’infection tuberculeuse initiale. La pathogénèse implique vraisemblablement une phase d’adhésion initiale des spores d’Aspergillus à l’épithélium respiratoire. Cette adhésion est suivie par la sécrétion d’enzymes protéolytiques qui facilitent la colonisation fongique et provoquent une réaction inflammatoire locale.
Cliniquement, l’aspergillome se manifeste souvent par des hémoptysies et une toux productive. Toutefois, il peut également présenter des symptômes moins spécifiques. Le pronostic de cette affection est préoccupant avec un taux de mortalité annuel estimé entre 5 et 6 %. Ce taux peut s’élever jusqu’à 26 % en cas d’hémoptysie massive.
Quant à la sinusite aspergillaire, elle se manifeste généralement comme une infection chronique des sinus, parfois sous forme pseudo-tumorale. Le diagnostic repose sur l’imagerie médicale et parfois des examens bactériologiques et mycologiques. Les formes cliniques varient entre invasives chroniques et non invasives, avec des symptômes incluant obstruction nasale, douleur, rhinorrhée et polypes nasaux. Dans les cas graves, des complications peuvent survenir, notamment des abcès oculaires ou des complications endocrâniennes, menaçant parfois le pronostic vital.
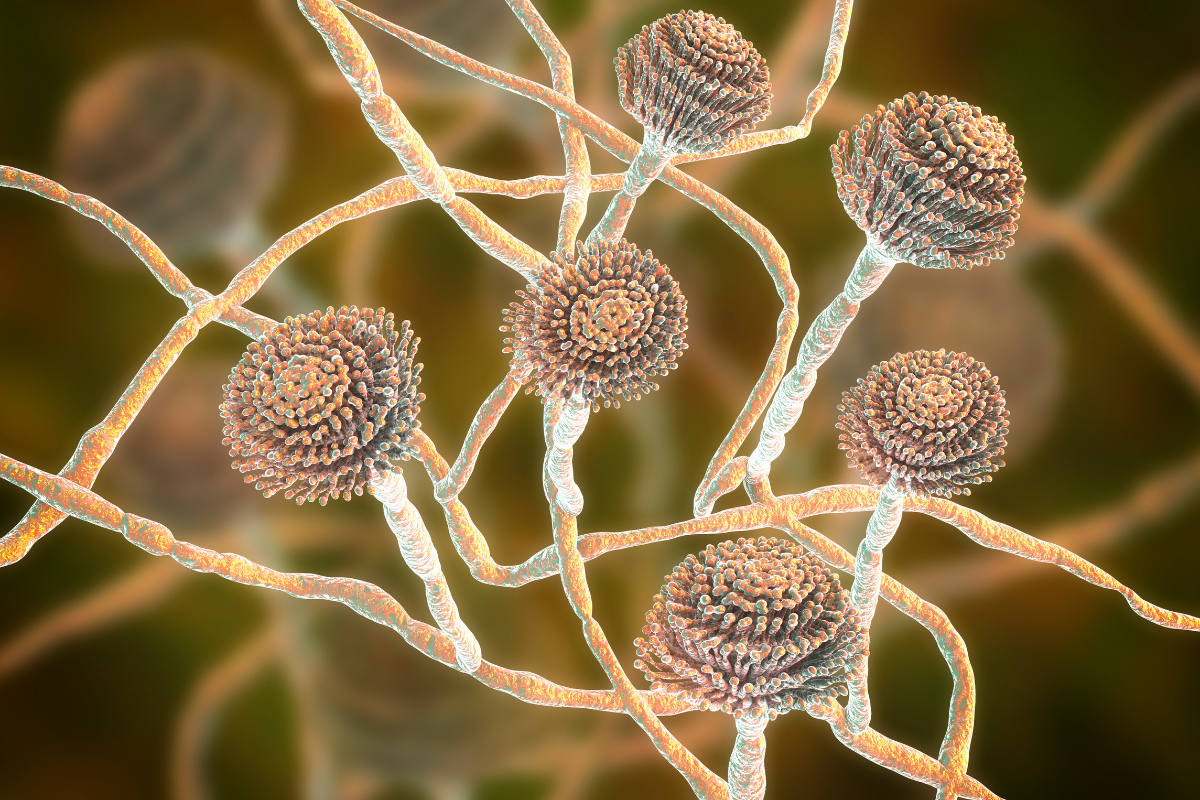
Zoom sur les Aspergillus
Les espèces du genre Aspergillus sont des champignons saprophytes, largement répandus dans l’environnement et régulièrement inhalés par la population humaine. Ils colonisent ainsi les cavités naturelles exposées aux poussières, principalement les voies respiratoires comme les bronches et les poumons, ainsi que parfois les conduits auditifs externes, sans causer de dommages significatifs.
Cependant, ces champignons peuvent devenir pathogènes et provoquer des affections spécifiques, appelées aspergilloses, surtout chez les individus immunodéprimés. Les espèces responsables incluent Aspergillus fumigatus, Aspergillus flavus, Aspergillus nidulans, Aspergillus versicolor, Aspergillus niger et Aspergillus terreus. Parmi celles-ci, Aspergillus fumigatus est particulièrement préoccupant, étant un agent opportuniste pouvant causer des maladies chez les personnes dont le système immunitaire est affaibli.
Les Aspergillus, relevant du règne Fungi, sont des organismes eucaryotes dotés d’une structure syncytiale et se caractérisent par leur mode de nutrition hétérotrophe. Ils se reproduisent de manière sexuée ou asexuée. Traditionnellement, ils sont classifiés dans les Ascomycota. Bien que la reproduction asexuée soit prédominante, certains membres de ce genre présentent également une capacité de reproduction sexuée.
En termes de pouvoir pathogène, divers facteurs influencent sur les infections par Aspergillus, notamment la virulence des souches, l’exposition environnementale et la sensibilité de l’hôte. Les Aspergillus sont capables de synthétiser diverses mycotoxines, telles que la gliotoxine et les aflatoxines, qui peuvent être immunosuppressives, cytotoxiques et même carcinogènes. De plus, ces champignons produisent des molécules antigéniques, comme le galactomannane, utilisé dans le diagnostic sérologique de l’aspergillose.
L’aspergillose est une mycose présente dans le monde entier, plus fréquente dans les régions chaudes et humides. Bien qu’elle ne soit pas contagieuse, plusieurs voies de contamination sont possibles, notamment respiratoire, digestive, cutanée, transplacentaire ou transcoquillière.
Comment la maladie est-elle diagnostiquée ?
Les méthodes diagnostiques pour les infections à Aspergillus comprennent généralement la culture des échantillons sur des milieux spécifiques pour champignons, ainsi que l’analyse histopathologique des prélèvements tissulaires. La recherche de l’antigène galactomannane dans le sérum ou le liquide de lavage bronchoalvéolaire est également courante.
Les cultures positives de crachats pour Aspergillus peuvent résulter d’une contamination environnementale ou d’une colonisation non invasive chez les patients présentant des pneumopathies chroniques. Cependant, leur signification est limitée sauf chez les patients à risques. En revanche, les cultures de crachats sont souvent négatives chez les patients atteints d’aspergillome ou d’aspergillose pulmonaire invasive.
On réalise souvent des radiographies thoraciques. En revanche, la tomodensitométrie thoracique (TDM) est plus sensible et recommandée pour les patients à haut risque, comme ceux présentant une neutropénie. On peut effectuer une TDM des sinus en cas de suspicion d’infection sinusale.
Le diagnostic définitif repose souvent sur la culture et l’histopathologie des prélèvements tissulaires, généralement obtenus par bronchoscopie ou biopsie percutanée. Cependant, ces tests peuvent s’avérer longs et pas toujours concluants. On base donc souvent la décision thérapeutique sur une forte présomption clinique. Les hémocultures sont généralement négatives, même en cas d’endocardite à Aspergillus, bien que les échocardiogrammes puissent montrer des signes de végétation intracardiaque.
Les tests de détection de l’antigène galactomannane sont spécifiques mais parfois peu sensibles, en particulier dans les cas précoces d’aspergillose pulmonaire invasive. La PCR peut être plus sensible que la culture seule pour l’identification de la souche d’Aspergillus. En outre, le taux de galactomannane et de 1,3-β-D-glucane peut être élevé dans le sang et le liquide cérébrospinal chez les patients atteints d’atteinte cérébrale. En cas de doute diagnostique, la négativité de ces tests peut aider à exclure un aspergillome.
Quel est le traitement ?
Le traitement de l’aspergillose est basé sur des recommandations de l’« Infectious Diseases Society of America » datant de 2008. Il comprend plusieurs options, notamment le voriconazole administré par voie intraveineuse initialement puis par voie orale dès que possible, ainsi que les dérivés lipidiques d’amphotéricine B en cas d’échec ou de contre-indication au voriconazole. En deuxième intention, on peut envisager la caspofungine et le posaconazole.
La recherche sur l’aspergillose vise à améliorer la compréhension des mécanismes infectieux et à développer des traitements plus efficaces. Les avancées en microscopie et en biotechnologie ouvrent la voie à de nouvelles approches thérapeutiques. On utilise les méthodes génomiques, transcriptomiques, protéomiques et métabolomiques pour mieux cerner ces champignons pathogènes. Certains instituts de recherche, comme l’Institut Hans-Knöll de Iéna en Allemagne, se concentrent sur cette problématique, explorant des médicaments plus performants et des techniques de renforcement immunitaire.
Dans le traitement de l’aspergillose, on utilise plusieurs médicaments, notamment le voriconazole, le posaconazole, l’isavuconazonium, l’amphotéricine B (y compris les formulations lipidiques) et les échinocandines en cas de nécessité. Les infections invasives sont généralement traitées de manière agressive, avec une attention particulière à l’arrêt de l’immunosuppression. Les aspergillomes, quant à eux, peuvent requérir une intervention chirurgicale plutôt qu’un traitement antifongique systémique, surtout en cas de risque d’hémoptysie.
En prophylaxie, le posaconazole ou l’itraconazole peuvent être envisagés chez les patients présentant un risque élevé, comme ceux atteints de maladie du greffon contre l’hôte ou de neutropénie associée à une leucémie myéloïde aiguë.
Résistance aux antifongiques
La résistance aux antifongiques chez les Aspergillus constitue un défi croissant dans le traitement des infections fongiques. On recommande de tester la sensibilité des souches aux antifongiques une fois identifiées en culture. Différents isolats d’un même patient peuvent présenter des sensibilités variables. À partir de la fin des années 1990, on a observé l’émergence de la résistance aux antifongiques, avec une prévalence croissante notamment dans certaines régions d’Europe occidentale et de Scandinavie.
On associe la résistance principalement aux triazoles, classe d’antifongiques largement prescrite en première intention. On la doit souvent à des mutations dans la protéine ciblée par les triazoles, la lanostérol 14α-déméthylase, codée par le gène cyp51A. Ces mutations rendent les souches résistantes à plusieurs triazoles simultanément. Depuis 2010, on a également identifié d’autres mécanismes de résistance.
Ce phénomène est préoccupant car il limite les options thérapeutiques disponibles. De plus, les triazoles représentent souvent les seules molécules administrables par voie orale. Les résistances peuvent se développer même chez des patients n’ayant jamais reçu d’antifongiques. Cela suggère une diffusion des souches résistantes dans l’environnement. En raison du faible nombre d’antifongiques disponibles et du risque de diffusion mondiale des résistances, la surveillance et la recherche de nouvelles stratégies thérapeutiques sont essentielles pour faire face à ce défi croissant dans le traitement des infections aspergillaires.
Prévenir la contamination
Les mesures générales de prévention visent à réduire l’exposition aux Aspergillus dans l’environnement de travail, notamment dans les industries agricoles et agroalimentaires. Il est essentiel de respecter les bonnes pratiques de récolte et de stockage des aliments pour animaux, de la paille et des litières. Il faut veiller à éliminer toute source potentielle de contamination. La minimisation de l’exposition aux poussières est primordiale. En utilisant des méthodes mécanisées, il faut une bonne aération et ventilation des locaux, ainsi qu’un nettoyage régulier.
La sensibilisation des travailleurs aux risques liés aux Aspergillus et à l’importance des mesures préventives est cruciale. Ils doivent disposer des moyens nécessaires pour maintenir une bonne hygiène personnelle. On parle notamment de l’accès à de l’eau potable, du savon, des essuie-tout en papier et une trousse de premiers secours. L’utilisation d’armoires-vestiaires distinctes permet de prévenir la contamination des effets personnels. De même, des vêtements de travail et des équipements de protection individuelle appropriés et bien entretenus sont nécessaires pour limiter l’exposition.
En ce qui concerne les pratiques individuelles, on recommande de maintenir une distance des opérations générant des poussières autant que possible et de porter un masque de protection FFP2 lors de la manipulation de matières moisies. Les règles d’hygiène personnelle, telles que le lavage des mains réguliers dans la journée de travail, ainsi que l’interdiction de boire, manger ou fumer sur le lieu de travail, doivent être respectées. De plus, on recommande de nettoyer régulièrement les vêtements de travail et de changer de vêtements en fin de journée.
Pour les travailleurs immunodéprimés, il est important de suivre les conseils médicaux sur la poursuite de l’activité professionnelle. Il faut éviter toute activité exposant à la dispersion de poussières végétales. En cas de maintien des activités, l’utilisation d’un appareil de protection respiratoire à ventilation assistée peut être nécessaire.
Quel est le statut de la maladie ?
Concernant le statut de la maladie, il est important de préciser qu’en ce qui concerne la santé animale. L’aspergillose n’est pas considérée comme une maladie animale contagieuse. Cela signifie qu’elle n’est pas généralement transmissible entre les animaux, que ce soit par contact direct ou par d’autres moyens de transmission.
En matière de santé publique, l’aspergillose ne relève pas d’une déclaration obligatoire. Ainsi, les cas d’aspergillose ne font pas l’objet d’un signalement systématique aux autorités sanitaires. D’autres maladies infectieuses nécessitent une déclaration afin d’assurer une surveillance épidémiologique et de protéger la santé publique. De plus, il convient de souligner que l’aspergillose n’est pas encore reconnue comme une maladie professionnelle.
En d’autres termes, les travailleurs ne peuvent pas bénéficier de la reconnaissance d’une aspergillose comme maladie professionnelle pour des indemnités ou des prestations spécifiques liées à leur activité professionnelle.
Enfin, concernant la classification de l’Aspergillus fumigatus dans le groupe de danger 2, cela indique qu’il présente un risque pour la santé. Ce risque n’atteint pas le niveau de dangerosité des agents pathogènes du groupe de danger 3. Cette classification revêt une importance capitale dans le domaine de la réglementation sur la santé et la sécurité au travail. En effet, il faut mettre en place des mesures spécifiques pour prévenir l’exposition des travailleurs à ce type d’agent pathogène.





Merci pour cet article. Je n’avais pas conscience de tout ça. Je vais me renseigner davantage !
Bonne journée,
Seb